DT3C:ADC抗体内化效率体外检测新工具
2014年MikiYamaguchi等人通过基因重组技术生产了一种重组蛋白,主要用于体外检测癌细胞对mAb的内化效率,进而筛选出更有效的单克隆抗体。该蛋白包括一个没有受体结合域的白喉毒素diphtheria toxin (DT)和链球菌蛋白G(Streptococcus protein G)的C1、C2、C3 (3C)结构域,即DT3C。
DT3C是继Mab-ZAP之后检测细胞内化mAb效率的有效工具,文献数据显示,与mAb-Mab-ZAP相比,mAb-DT3C模拟的抗体偶联药物( Antibody-Drug Conjugate,ADC)具有易制备、分子量稳定及抗体内化效率高等特点[1]。
为了进一步验证DT3C在ADC抗体药内化效率检测中的作用,2015年,MikiYamaguchi等人又利用DT3C作为工具筛选了一种靶向胰腺导管腺癌细胞的anti-Mucin 13单克隆抗体[2]。

据不完全统计,目前DT3C作为检测mAb内化能力的工具已经用于近130项ADC药物mAb筛选专利中,那DT3C究竟是如何介导ADC药物mAb内化效率检测的呢?
什么是ADC药物内化?
在细说DT3C是如何介导ADC药物mAb内化效率检测之前,我们先来了解下什么是ADC药物mAb内化。
ADC药物由抗体、连接子和小分子毒素组成,是通过连接子(linker)将具有生物活性的小分子药物偶联至单克隆抗体上。单抗通过肿瘤细胞相关抗原的特异性和靶向性定位到肿瘤细胞表面,并通过内吞/内化作用进入细胞,连接子在细胞内低pH值或溶酶体蛋白作用下断裂,释放出具有活性的细胞毒药物,破坏DNA或阻止肿瘤细胞分裂,从而对肿瘤细胞起到杀伤作用。
该类药物利用抗体的特异性靶向运输药物分子到靶组织发挥作用,将细胞毒药物强大的细胞杀伤能力集中于肿瘤细胞,降低对正常组织的毒副作用。
在ADC设计研发过程中,首要的是药物靶点的选择。对于药物靶点的选择,除了要在肿瘤过度表达外,另一个重要因素是内吞/内化的效率,这是药物释放活性所必需的。抗体能否被内化主要由靶点决定,而抗体内化的效率则与抗原密度、抗体亲和力以及抗体与抗原结合表位密切相关。同一靶点的不同抗体也会表现出不同的内化效率。
DT3C如何介导ADC抗体药物内化效率体外检测?
如前所述,ADC药物中抗体能否被内化是药物效果评价的重要因素。这里你可能会疑问,ADC药物中抗体的内化与单纯的抗体药物内化有区别吗?为什么DT3C是专门针对的ADC药物呢?
首先,ADC药物中抗体的内化与单纯的抗体药物内化肯定是有区别,ADC药物的分子量是大于单纯的抗体药物的,相同条件下,二者的内化效率肯定是不一样的。
其次,DT3C替代的是ADC药物分子中的小分子药物,是一种免疫毒素,mAb-DT3C偶联物模拟的是ADC药物。
如下图所示:mAb-DT3C偶联复合物识别并结合细胞表面抗原后,mAb-DT3C-抗原复合物被内化;然后DT3C被胞质弗林蛋白酶(furin protease)切割,DT3C的催化结构域被释放到细胞质中。DT3C的催化结构域导致延伸因子(EF)-2的 ADP-核糖基化,随后通过抑制蛋白质翻译机制导致细胞毒性。
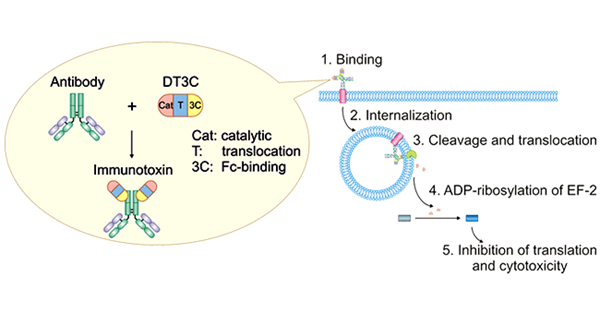
图1. Mechanism of antibody:DT3C-induced cytotoxicity
作为ADC药物抗体内化检测工具,DT3C优势可总结为以下三点:
第一,mAb-DT3C偶联物制备简单,仅在室温下孵育30min就能形成,而且在体外可以发挥患者给ADC药物后的功能;
第二,DT3C可与来自不同物种(如人、小鼠、兔、山羊)的任何 IgG 结合,形成 mAb-DT3C 偶联物,从而进一步扩大了DT3C作为mAb抗体内化检测工具的范围;
第三,只有当偶联物被靶细胞内化时,mAb-DT3C 偶联物才会显著降低细胞活力。
值得一提的是,在DT3C之前,Mab-ZAP是唯一能够检测细胞内化mAb 效率工具。Mab-ZAP由小鼠抗体和核糖体失活蛋白皂草素组成。当 mAb-Mab-ZAP 偶联物被细胞内化时,由于皂草素的毒性,细胞会发生凋亡。所以可以通过细胞的存活率来检测mAb是否被细胞内化。
但是,不能排除Mab-ZAP本身在一定程度上可能降低mAb内化效率,因为 Mab-ZAP是一种包含抗小鼠抗体的大分子。与Mab-ZAP相比,mAb-DT3C偶联物的分子量稳定且小于mAb-Mab-ZAP。并且,相关实验数据表明,mAb-DT3C内化效率高于mAb-Mab-ZAP。
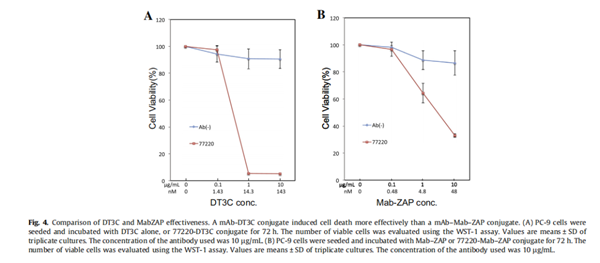
来源:M. Yamaguchi et al. / Biochemical and Biophysical Research Communications 454 (2014) 600–603
华美CUSABIO提供高纯度的DT3C蛋白(Code: CSB-EP360556CQR1),助力ADC药物研发。
①可体外模拟ADC药物功能
②mAb-DT3C复合物制备简单
③可与多个来源的mAb结合
④抗体内化效率高于Mab-ZAP
ADC药物内化途径
目前,关于mAb-DT3C复合物内化的具体途径暂无相关文献报道。结合常规的ADC药物内化途径,一般来说,内化又称为内吞,正常的内吞作用可分为三个阶段:芽的形成、膜的弯曲和囊泡的成熟和膜的断裂并释放到细胞质中。
ADC药物内化途径可按是否依赖于网格蛋白分为:网格蛋白介导的内吞作用和非网格蛋白介导的内吞作用。
非网格蛋白介导的内吞作用又可进一步分为:小窝介导的内吞作用、小窝蛋白非依赖性载体蛋白/GPI-富集的早期内区室(CLIC/GEEC)和巨胞饮作用。
多种内吞途径有重叠的方面,因此内吞的过程一般是高度灵活和复杂的。这里以小窝介导的内吞作用为例:
网格蛋白介导的内吞作用(CME)包括几个连续和部分重叠的步骤。对于质膜上的一些受体而言,CME可以组成型发生;其他受体则需要配体或抗体结合后启动。当细胞质中的内吞衣壳蛋白开始聚集在质膜的内小叶上时,CME就开始了。衣壳蛋白通过从细胞质中招募并与额外的蛋白质接头并相互作用,继续组装和生长。关键的衔接蛋白使膜弯曲,从而将内化受体/配体集中到一个“网格蛋白包被坑”(CCP)中。在CCP颈部因CCP内陷变大而收缩的点处会通过断裂与质膜分离。肌动蛋白聚合有助于将CCP “向内”拉入细胞质,直到完全分裂,CCP 被释放并变成网格蛋白包被的囊泡 (CCV)。最后,CCV外壳解体,CCV与内体融合,分拣到确定的亚细胞位置,或者可以循环回细胞表面[3]。
近年来,研发人员致力于将 ADC 药物的应用扩展到其他疾病治疗领域,包括传染病和免疫相关疾病等。未来国内 ADC 药物市场规模也将十分巨大,在这一广阔市场前景的驱动下,国内大量医药企业进入到这一领域,并从这一领域取得突破。
华美生物跨膜蛋白系列产品助力新药开发
跨膜蛋白是目前最主要的药物靶点,占现阶段已知药物靶点的 60%以上,以跨膜蛋白为靶点的创新药研发一直是医药领域的研究热点。由于跨膜蛋白具有疏水亲脂的跨膜域,必须借助细胞膜的磷脂双分子层这一特殊环境来维持正确结构、保持生物活性,同时跨膜次数越多其具有的疏水亲脂跨膜区越多,在宿主细胞中表达水平越低、制备难度越大,因此体外制备有活性的跨膜蛋白是目前公认的技术难题。
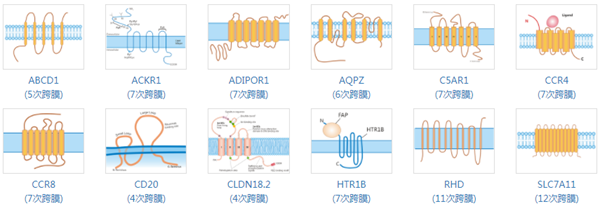
具有全长完整结构的多次跨膜蛋白在药物研发中具有重要意义。为助力跨膜蛋白靶点药物的开发,华美生物继2015年开发出表达跨膜蛋白的无细胞表达平台后,又开发出基于哺乳细胞的病毒样颗粒(VLPs)等多个技术平台,已成功制备200余种跨膜蛋白,包含CCR8、CCR4、CD20、Claudin-18.2等多个热门靶点。
华美CUSABIO所表达的跨膜蛋白产品具有全长、稳定、天然构象、活性高等特点,并经过功能性ELISA/SPR/FACS等多种蛋白应用分析技术验证,可覆盖多个应用场景,强势助力新药开发。
上一篇:整合优质资产优化全产业链 星湖科技或将打造生物发酵领域尖端企业
下一篇:没有了
- 海正生物:掌握核心科技市场份额持2022.07.28
- 浩瀚深度:新三板成功摘牌 即将登2022.07.27
- 整合优质资产优化全产业链 星湖科2022.07.27
- 八一建军节前平湖市退役军人事务2022.07.27
- 百利天恒:研产销创新一体化起航 2022.07.25
- 百龙创园4月21日于上交所主板上市2021.04.20
最新文章
-
海正生物:掌握核心科
7月28日,浙江海正生物材料股份有......

-
浩瀚深度:新三板成功
2022年6月13日北京浩瀚深度信息技......

-
整合优质资产优化全
日前,星湖科技(600866)发布重组草......

-
八一建军节前平湖市
每年的8月1日是中国人民解放军建......

推荐文章
-
海正生物:掌握核心科
7月28日,浙江海正生物材料股份有......

-
浩瀚深度:新三板成功
2022年6月13日北京浩瀚深度信息技......

-
整合优质资产优化全
日前,星湖科技(600866)发布重组草......

热门文章
-
DT3C:ADC抗体内化效
2014年MikiYamaguchi等人通过基因......

-
福元医药:校企携手
7月25日下午,安徽中医药大学党委......

-
飞沃科技:用心做好每
创业板上市委员会2022年第43次审......